Закон Гей-Люссака или также известный как закон комбинированных объемов, является важным законом химии. Он обозначает, что объем газа, образующегося или расходующегося в химической реакции, пропорционален коэффициентам стехиометрии газовых реагентов и обратно пропорционален их объему при нормальных условиях. Открытый французскими учеными Жозефом Луи Гей-Люссаком и Жаком Шарлем Кулоном в начале XIX века, этот закон имеет большое значение в газовой химии и на практике широко используется для расчета объемов и объемных соотношений в химических реакциях.
Основная формула для закона Гей-Люссака выглядит следующим образом: V1/V2 = n1/n2, где V1 и V2 — объемы газов в исходной и конечной точках соответственно, а n1 и n2 — коэффициенты стехиометрии для газовых компонентов реакции.
Примером применения закона Гей-Люссака может служить реакция горения метана (CH4) в кислороде (O2), при которой образуется углекислый газ (CO2) и вода (H2O). Согласно закону Гей-Люссака, объемы всех газов будут пропорциональны коэффициентам стехиометрии реакции. В данном случае, уравнение реакции выглядит следующим образом: CH4 + 2O2 → CO2 + 2H2O. Учитывая коэффициенты стехиометрии, объем CH4 будет равен объему CO2 (1:1), а объем O2 будет вдвое больше.
Знание закона Гей-Люссака позволяет ученым и химикам проводить точные расчеты объемов газов, участвующих в различных химических реакциях. Это помогает в определении оптимальных условий для производства различных веществ, а также в прогнозировании и планировании технологических процессов в промышленности. Поэтому, понимание и применение закона Гей-Люссака имеет большое значение для развития химической науки и техники.
Закон Гей-Люссака формула:
Закон Гей-Люссака, также известный как закон однородного нагревания газов, устанавливает зависимость между давлением и температурой идеального газа при постоянном объеме. Формула закона Гей-Люссака выглядит следующим образом:
P₁/T₁ = P₂/T₂
где P₁ и P₂ — начальное и конечное давление газа соответственно, T₁ и T₂ — начальная и конечная температура газа соответственно.
Закон Гей-Люссака применим к идеальным газам при условии, что масса газа и его состав остаются неизменными. Закон позволяет предсказывать изменение давления газа при изменении его температуры или наоборот.
Применение закона Гей-Люссака особенно полезно в химической и физической науке. Например, при проведении экспериментов с газами можно использовать формулу закона для вычисления изменения давления, если известны начальная и конечная температура.
Закон Гей-Люссака также находит применение в технических расчетах, например, при проектировании систем отопления или охлаждения, где необходимо учитывать изменение давления воздуха в зависимости от температуры.
Определение, объяснение и история
Изначально закон был открыт именами Жан-Луи Гей-Люссака и Джозефа Гея-Люссака в начале 19-го века. Они обнаружили, что если объем газа увеличивается (или уменьшается) в постоянных пропорциях, то его температура (или давление) также увеличивается (или уменьшается) в тех же пропорциях.
Закон Гей-Люссака можно представить математически в виде формулы:
V1/T1 = V2/T2, где V1 и T1 — начальный объем и температура, V2 и T2 — конечный объем и температура.
Этот закон является важным элементом идеального газового закона, который описывает поведение большинства газов при нормальных условиях. Он также находит широкое применение в различных областях, включая химию, физику и инженерию.
Гей-Люссак:
Закон Гей-Люссака, также известный как закон одинаковых объёмов, утверждает, что для газов реакция протекает при постоянном объеме вещества и стандартных условиях (температуре и давлении), мольные соотношения реагентов и продуктов относятся друг к другу простыми числами.
Например, рассмотрим реакцию между аммиаком (NH3) и хлороводородом (HCl), которая протекает при постоянном объеме вещества и стандартных условиях:
NH3 + HCl → NH4Cl
Согласно закону Гей-Люссака, для данной реакции моли аммиака и хлороводорода относятся друг к другу простыми числами. Например, если у нас есть 2 моля аммиака, то для полного протекания реакции понадобится 6 молей хлороводорода.
Закон Гей-Люссака является одним из основных законов химии и широко применяется для расчета мольных соотношений в химических реакциях.
Формула:
В законе Гей-Люссака формула связывает давление и температуру идеального газа при постоянном объеме:
p/T = k
где:
- p — давление газа;
- T — абсолютная температура газа;
- k — постоянная, которая обычно равна 1.
Формула позволяет вычислить давление газа при изменении его температуры и наоборот. Она основана на наблюдении, что при постоянном объеме идеального газа, его давление прямо пропорционально абсолютной температуре. Это означает, что при увеличении температуры газа его давление также увеличивается, и наоборот, при уменьшении температуры газа его давление уменьшается.
Формула Гей-Люссака является одной из основных формул в газовой динамике и находит широкое применение в физике, химии и инженерных науках.
Примеры применения в химии
Одним из примеров применения закона Гей-Люссака является расчет количества газа, участвующего в химической реакции. Зная начальные условия, такие как объемы и давления газов, можно использовать этот закон для определения итоговых условий, таких как изменение объема или давления, а также количество газа, участвующего в реакции.
Другой пример применения закона Гей-Люссака связан с расчетом тепловых эффектов химических реакций. Закон Гей-Люссака позволяет определить количество тепла, выделяющегося или поглощаемого в ходе реакции, основываясь на изменении объема газов или изменении их давления.
Закон Гей-Люссака также может быть использован для определения коэффициентов стехиометрически сбалансированных уравнений. На основе этого закона можно определить отношение между объемами газов, участвующих в реакции, что помогает в составлении правильного уравнения реакции и понимании ее протекания.
В целом, закон Гей-Люссака является важным инструментом в химии и применяется во многих областях, от расчета количества реагентов и продуктов реакции до определения тепловых эффектов и стехиометрических уравнений.
Применение в законе Дальтона:
Закон Гей-Люссака, также известный как уравнение состояния идеального газа, имеет применение в законе Дальтона. Закон Дальтона утверждает, что сумма давлений отдельных газов в смеси равна общему давлению этой смеси.
Согласно закону Гей-Люссака, выраженному формулой P1/T1 = P2/T2, давление идеального газа пропорционально его абсолютной температуре. Это означает, что при постоянном объеме газа, его давление прямо пропорционально его температуре.
При применении закона Дальтона, мы можем использовать закон Гей-Люссака для определения частного давления каждого газа в смеси. Мы предполагаем, что каждый газ ведет себя как идеальный газ и имеет свое собственное давление, которое можно определить с использованием закона Гей-Люссака.
Например, рассмотрим смесь, состоящую из газа А и газа В. Если давления отдельных газов равны P1 и P2, и общее давление смеси равно P, то согласно закону Дальтона:
- давление газа А можно рассчитать как P1 = (P * X1) / (X1 + X2),
- давление газа В можно рассчитать как P2 = (P * X2) / (X1 + X2),
где X1 и X2 — доли соответствующих газов в смеси.
Применение закона Гей-Люссака в законе Дальтона позволяет определить долю каждого газа в смеси и его частное давление. Это особенно важно при работе с смесями газов, например, в химических реакциях, где знание доли и давления каждого газа является необходимым для правильного вычисления и предсказания результатов.
Применение в химических реакциях:
Применение закона Гей-Люссака в химических реакциях позволяет определить эмпирические формулы соединений, а также рассчитать объемы газовых продуктов, которые образуются или участвуют в реакции.
Приведем пример применения закона Гей-Люссака в химической реакции сжигания метана (CH4):
CH4 + 2O2 → CO2 + 2H2O
Пропорция между объемами газов можно выразить следующим образом:
1 объем CH4 + 2 объема O2 → 1 объем CO2 + 2 объема H2O
Это означает, что при сгорании 1 объема метана необходимо 2 объема кислорода и образуется 1 объем диоксида углерода и 2 объема водяного пара.
Таким образом, закон Гей-Люссака позволяет определить соотношение между объемами газовых реагентов и продуктов в химической реакции, что является важным при расчете количества реагентов или продуктов в химическом процессе.
Примеры применения в жизни и технике
Закон Гей-Люссака, также известный как закон Дальтона, находит свое применение в различных сферах нашей жизни и технике. Этот закон описывает зависимость между давлением и температурой газовой смеси при постоянном объеме и количестве вещества.
Один из примеров применения этого закона — его использование в радиотехнике, в частности при проектировании и разработке радаров и радиоустройств. Закон Гей-Люссака позволяет оптимизировать работу радиоустройств и радаров, учитывая влияние изменения температуры на функционирование газовых смесей, используемых в этих устройствах.
Еще одним примером применения этого закона является его использование в промышленности, в частности при проектировании и эксплуатации оборудования, работающего с газами. Закон Гей-Люссака позволяет учесть изменение давления и температуры в газовых системах и скорректировать работу оборудования для достижения оптимальных условий процесса.
Также закон Гей-Люссака находит применение в пищевой промышленности. Он используется для контроля и регулирования процессов сушки и газирования продуктов питания, а также при проектировании и эксплуатации систем хранения и транспортировки пищевых газовых продуктов.
| Примеры применения закона Гей-Люссака: |
|---|
| Разработка радаров и радиоустройств в радиотехнике |
| Проектирование и эксплуатация оборудования, работающего с газами в промышленности |
| Контроль и регулирование процессов сушки и газирования продуктов питания в пищевой промышленности |
Применение в производстве газов:
Одним из основных применений закона Гей-Люссака в производстве газов является контроль и регулирование давления газовых смесей. Например, в процессе производства газов важно поддерживать определенное давление в системе. С помощью закона Гей-Люссака можно определить зависимость между изменением температуры и давления газовой смеси, что позволяет контролировать и регулировать давление в производственной системе.
Другим применением закона Гей-Люссака является контроль и регулирование температуры газовых процессов. Изменение температуры может оказывать существенное влияние на свойства газов и их производительность. С помощью закона Гей-Люссака можно определить, как изменение температуры влияет на изменение давления газа. Это позволяет контролировать и регулировать температуру в процессе производства газов, обеспечивая оптимальные условия для работы системы.
Также закон Гей-Люссака применяется в производстве газов для определения объема газа при различных температурах и давлениях. Зная зависимость между объемом газа, температурой и давлением, можно рассчитать объем газа в процессе производства. Это позволяет контролировать и управлять объемом газа в системе.
Вопрос-ответ:
Что такое закон Гей-Люссака?
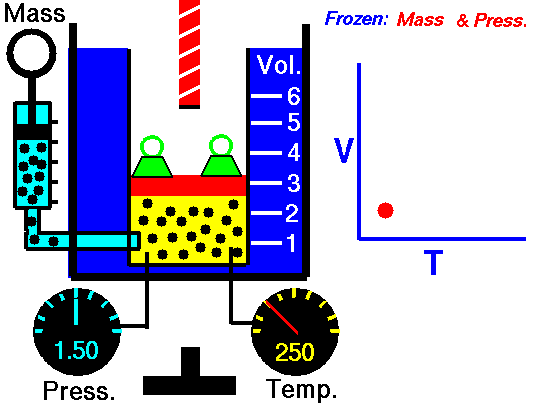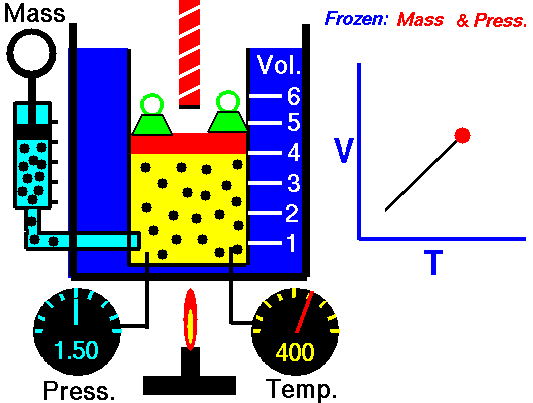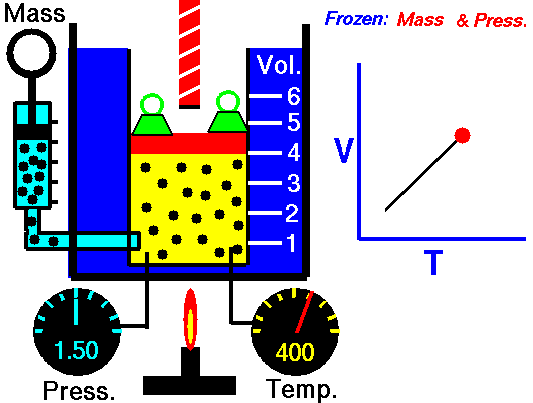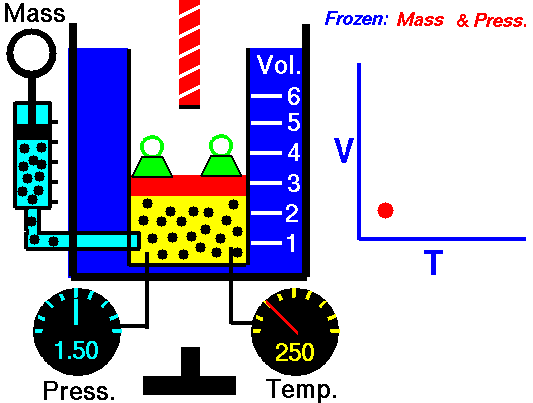
Закон Гей-Люссака — это экспериментальный закон, который устанавливает пропорциональность между объемом газа и его абсолютной температурой при постоянном давлении. Формула закона Гей-Люссака выглядит следующим образом: V/T = k, где V — объем газа, T — абсолютная температура, k — постоянная пропорциональности.
Как объяснить закон Гей-Люссака?
Закон Гей-Люссака можно объяснить следующим образом: при постоянном давлении, если мы увеличиваем абсолютную температуру газа, то его объем также увеличивается в определенной пропорции. Это связано с тем, что при повышении температуры газовые молекулы движутся быстрее и сталкиваются друг с другом с большей энергией, что приводит к расширению объема газа.
Как применяется закон Гей-Люссака в практике?
Закон Гей-Люссака имеет множество практических применений. Например, его используют при расчете объема газа при изменении температуры или при измерении температуры с помощью объема газа. Также закон Гей-Люссака является основой для формулы Шарля, которая описывает изменение объема газа при изменении его температуры при постоянном давлении.
Что происходит с объемом газа при увеличении температуры?
При увеличении температуры газа его объем также увеличивается, следуя закону Гей-Люссака. Это происходит из-за того, что при повышении температуры газовые молекулы движутся быстрее и сталкиваются друг с другом с большей энергией, что приводит к расширению объема газа.
Какой физический смысл имеет постоянная пропорциональности k в законе Гей-Люссака?
Постоянная пропорциональности k в законе Гей-Люссака является мерой величины расширения газа при повышении температуры. Она зависит от свойств конкретного газа и может быть определена экспериментально. К примеру, для идеального газа, k будет равна 1/273,15, если температура измеряется в градусах Цельсия и в кельвинах.
Что такое закон Гей-Люссака?
Закон Гей-Люссака — это один из фундаментальных законов физики, который описывает зависимость между объемом и температурой газа при постоянном давлении. Согласно этому закону, при постоянном давлении, объем газа прямо пропорционален его температуре.
Как можно объяснить закон Гей-Люссака формулу?
Закон Гей-Люссака формула объясняет, что при постоянном давлении, объем газа изменяется прямо пропорционально его температуре. Формула для закона Гей-Люссака выглядит следующим образом: V1/T1 = V2/T2, где V1 и T1 — начальный объем и температура газа, а V2 и T2 — конечный объем и температура газа. Это означает, что если увеличить температуру газа при постоянном давлении, то его объем также увеличится в определенной пропорции.

